免疫疗法可治愈癌!2018年诺贝尔生理学或医学奖带来福音!
2018年诺贝尔生理学或医学奖得主:美国免疫学家詹姆斯·艾利森(James P Alison)和日本免疫学家本庶佑(Tasuku Honjo)
詹姆斯·艾利森(James P。 Allison)是美国著名免疫学家,美国得克萨斯大学M·D·安德森癌症中心免疫学研究平台负责人、免疫学教授。艾利森被认为是分离出T细胞抗原(T-cell antigen)复合物蛋白的第一人,他同时发现,如果可以暂时抑制T细胞表面表达的CTLA-4这一免疫系统“分子刹车”的活性,就能提高免疫系统对肿瘤细胞的攻击性,从而缩小肿瘤的体积。他对T细胞发育和激活,以及及免疫系统“刹车”的卓越研究,为癌症治疗开创了全新的免疫治疗思路——释放免疫系统自身的能力来攻击肿瘤。
本庶佑(Tasuku Honjo)日本免疫学家,美国国家科学院外籍院士,日本学士院会员。现任京都大学高等研究院特别教授。本庶教授建立了免疫球蛋白类型转换的基本概念框架,他提出了一个解释抗体基因在模式转换中变化的模型。1992年,本庶首先鉴定PD-1为活化T淋巴细胞上的诱导型基因,这一发现为PD-1阻断建立癌症免疫治疗原理做出了重大贡献。
诺奖官方给出的获奖理由是:“他们通过抑制免疫负调节机制,发现了新的癌症治疗方法。”
什么是抑制免疫负调节机制?它对于癌症治疗有什么功效?这一发现的意义是什么?为此,有媒体记者专访了浙江大学医学院免疫学研究所教授鲁林荣。
癌症治疗领域最为常见的疗法是先识别出癌细胞,再进行针对性的治疗。而“癌症免疫疗法” 的思路则是通过人体自身的免疫系统消灭癌细胞。与手术、放疗和化疗等传统手段明显不同,肿瘤的免疫治疗,对人类健康和生物产业而言是一场“革命”。
“不论是詹姆斯·艾利森发现的细胞毒性T淋巴细胞相关抗原(CTLA-4)或是本庶佑发现的PD-1,都统称为免疫检查点分子。”鲁林荣告诉记者,“他们最大的贡献就是发现了肿瘤治疗中这两个重要的调控分子 。”
如今,肿瘤免疫治疗种类众多,但本质上绝大多数都是通过 T细胞发挥抗肿瘤作用,从传统细胞因子、多肽类药物到最新的免疫检查点抑制剂与 CAR-T细胞治疗,均是间接或者直接激活人体 T细胞来清除肿瘤细胞。
T细胞是人体内一种免疫细胞,它不仅能够帮助我们抵御外来各种病原体(如细菌、病毒、真菌、寄生虫)的侵扰,还是体内的“免疫监视员”,能够及时发现并清除体内的异常细胞(如癌变的细胞),将某些疾病(如恶性肿瘤)扼杀在摇篮中。
鲁林荣表示:“患上肿瘤后,抗肿瘤的T细胞会跑到肿瘤局部,而肿瘤为逃避攻击,会促使T细胞表面产生抑制分子,肿瘤得以继续发展、扩散。而在癌症免疫疗法中,通过这些免疫抑制分子,会产生抗体阻断抑制,从而激活T细胞的免疫‘杀伤’功能。”
据鲁林荣介绍,两位华人科学家同样在该方面的研究中有所发现。陈列平在肿瘤细胞表面发现了真正具有肿瘤特异性的一个蛋白分子,PD-1的配体(PD-L1),随后发现利用抗体关闭PD-1/PD-L1通路,可增强自身免疫反应,打破肿瘤免疫逃逸机制,继而抑制肿瘤,掀起了验证通过抑制PD-1(或者PD-L1)是否能抗癌的研究新方向。邹伟平首次阐明PD-L1 (B7-H1)在人体肿瘤微环境中的表达,调控和功能阻断,为目前免疫切点的肿瘤免疫治疗打下了坚实基础。
2014年,基于“免疫系统刹车”抑制的第一个PD-1抑制剂在美国上市;2018年6月15日,中国食品药品监督管理总局(CFDA)正式批准PD-1抗体纳武利尤单抗注射液(商品名欧狄沃,英文名Opdivo)上市,针对的适应症是“系统治疗的非小细胞肺癌(不包括敏感基因突变患者)”,意味着我国的肿瘤治疗真正进入了“免疫”时代。
》》》》》我们找到了 2014年6月发表于《环球科学》的文章,详细介绍了癌症免疫疗法取得的巨大医学进步
2004年6月,一位刚从大学毕业的姑娘分到我这里做检查。她那年22岁,刚刚订婚。在毕业前的几个月里,雪莉(化名)一直被咳嗽搞得不得安宁。CT(computed tomographic,即计算机断层扫描)检查发现,她的双肺有多处阴影,而进一步的活组织检查显示,这是一种来自皮肤的恶性肿瘤——转移到肺部的黑色素瘤。雪莉从不知道自己患有黑色素瘤,她马上开始化疗,并匆忙推迟了婚期。
接下来的两年里,雪莉接受了两轮化疗和脑部放疗,但不幸的是,治疗只减缓了肿瘤的恶化速度,却没能阻止肿瘤的转移。就在快要无计可施时,我告诉她,医院正在开展一种新药的临床试验,这种药物或许可以增强患者自身的免疫系统,使我们的身体有能力自己对抗癌症。
这是一项随机试验,也就是说,并非每位受试者都能得到这种名叫“MDX-010”的新药,但雪莉还是答应参与试验。经过4个疗程的治疗后,雪莉拍摄了一组新的CT。结果显示,她体内所有的黑色素瘤都消失了。从那以后,雪莉一直保持着无瘤状态。现在她已为人母,有了两个漂亮又健康的孩子。用她自己的话说,她“又找回了自己的人生”。
在我这样一个肿瘤专家看来,雪莉的痊愈,将人世间的一个夙愿带进了现实:科学家的确可以通过改造人体自身的免疫系统,创造出强大的抗癌疗法。过去一年中,采用与雪莉类似的疗法,或是其他治疗白血病、肾脏与肺部癌症的免疫疗法的患者,纷纷将捷报传来,医学界因此备受鼓舞。尽管免疫疗法并非万能灵药,但对于晚期肿瘤的治疗而言,这一最新成果,无疑是人们在过去几十年间取得的最大进步。
免疫系统的多重防御
免疫系统可以遏制肿瘤,这并非新闻。早在100多年前,纽约癌症医院(New York Cancer Hospital,纪念斯隆-凯特琳癌症中心的前身)的外科医生威廉·科利(William Coley)就曾试图用高温杀死的细菌刺激免疫系统,从而对抗恶性肿瘤。科利发现,一些在癌症手术后发生感染的患者,存活的时间似乎更长,他由此猜想,病原体在机体内激起的免疫反应,可能也会对肿瘤造成影响。
在接下来的几十年里,基础研究领域的科学家对免疫系统进行了深入的研究,揭示了人体防御系统的分子组成、其中的化学介质,以及精确控制该系统的分子开关。在研究的过程中,科学家逐渐了解了免疫系统是如何动员起来,进而去发现可能引起严重感染的病原体(例如细菌和病毒)的。与之同样重要的是,研究人员亦深入理解了免疫系统的“检查”与“平衡”机制,正是因为这些机制的存在,免疫反应才不至于失控,使过多的正常组织受到损伤。总而言之,科学家已经获得了足够的细节信息,知道了免疫系统如何应对肿瘤,而肿瘤又如何影响免疫系统。
机体的第一层防御机制,包括了对抗细菌与病毒的非特异性免疫反应,这一过程由血液中的白细胞(如中性粒细胞和单核细胞)负责协调。这些细胞隶属于“固有免疫系统”(innate immune system),专门识别细菌或病毒中常见的分子结构——例如部分表面结构,或是有别于高等生物的DNA和RNA分子。尽管这些白细胞并不能特异性地识别并攻击某些蛋白结构,却能抵挡许多微生物的入侵,将其分解成小分子片段——即所谓的“抗原”(antigen)。在这之后,免疫系统的其他成员便会将抗原视为异物,予以消灭。
负责机体第二层防线的细胞,构成了我们的“适应性免疫系统”(adaptive immune system)。它们的工作始于对抗原的识别,继而发动更为精准的免疫攻击。如果攻击有效,机体就会产生对该种病原的“记忆”,一旦再次遇到相同的入侵病原,便能更轻易地将其击溃。T细胞和B细胞是适应性免疫应答的核心角色。T细胞有多种类型,但它们都发源于胸腺——一个位于胸部正中、心脏上方的组织。B细胞则来自骨髓,能够制造抗体。抗体分子与T细胞上一些特定的分子结构一样,都能够附着在特定的抗原上,免疫系统因此可以锁定目标,消灭细菌和表面带有抗原的受感染细胞。
当机体识别并消灭有害病原时,固有免疫和适应性免疫若能通力合作,免疫系统便能达到最佳状态。此外,有一类T细胞还能长时间保留分子记忆,以便在相同的威胁再次出现时,更快地发起免疫应答。
当然,癌症并不同于感染。癌细胞是发生了遗传变异等病理变化的自体细胞,但尽管如此,免疫系统还是能够识别出恶性肿瘤细胞。这是因为,后者会表达异常的分子碎片,对T细胞或者B细胞来说,这些分子碎片相当于异物。然而,在多种因素的作用下,机体对于癌症的免疫应答并没有产生显著的效果。多年以来,研究人员一直致力于刺激机体的免疫系统,强化其对癌症的免疫应答,然而,得到的结果并不稳定。最近,一些更有效、更稳定的治疗手段,将癌症的免疫治疗带到了一个新的方向。研究人员发现,有些时候,癌症可以与免疫系统的“刹车”协同作用,显著抑制机体对恶性肿瘤细胞的免疫应答,而我们所说的“新方向”,正是瞄准免疫系统的“分子刹车”,使之失去效用。
阻断免疫关卡
那种拯救了雪莉的试验药物,正是遵循这一思路设计出来的。这种药物的诞生,得益于对一种名叫CTLA-4的蛋白的研究。许多T细胞都能表达CTLA-4蛋白,但是,只有当特定的T细胞识别出作用目标,同时接收到来自其他分子的启动信号时,该蛋白才会被激活。一旦激活,CTLA-4就会和其他蛋白协同作用,起到分子刹车,或是“检查点”的作用,防止过度活跃的免疫系统对机体造成破坏。
我们可以从那些体内没有“检查点”的动物身上,窥见这一机制的必要性。经基因工程改造、体内缺乏CTLA-4蛋白的小鼠仅能存活3~4周。如果机体没有任何阻止免疫应答的机制,过度活跃的T细胞就将入侵机体所有的正常器官,将它们完全破坏。这一发表于1995年的研究成果表明,CTLA-4蛋白的永久性缺乏,将会引发灾难性的自身免疫反应。
就在同一年,加利福尼亚大学伯克利分校的詹姆斯·艾利森(James Allison)提出假设:如果可以暂时抑制CTLA-4这一“分子刹车”的活性,是否就能提高免疫系统对肿瘤细胞的攻击性,从而缩小肿瘤的体积?艾利森和同事设计了验证性实验,他们向小鼠体内注入合成的抗体,以阻断CTLA-4的活性。
结果显示,抑制CTLA-4,确实可以使多种肿瘤缩小——包括移植到实验动物上的结肠癌和肉瘤。另外一些实验显示,给实验小鼠注射抗CTLA-4的抗体,以及一种实试验性疫苗(该疫苗是由经过修饰的黑色素瘤细胞制造的)后,小鼠身上的黑色素瘤显著缩小了(疫苗的目的,正是激起机体对该种肿瘤的特异性免疫反应)。
研究人员的下一步任务,是将这种名为“免疫检查点阻断”的技术,从实验室转移到对人体的治疗上来。艾利森在生物技术公司Medarex找到了志同道合的伙伴,该公司已研制出人类的CTLA-4抗体——最开始名叫“MDX-010”,也就是我们现在熟知的伊匹单抗(ipilimumab),并招募那些对其他疗法完全无应答的晚期癌症患者,开展临床试验。
无论是在首批试验,还是一系列后续试验中,我们都能看到一些患者的肿瘤的体积明显缩小了。而在此之前,科学家对免疫疗法进行的早期评估,往往会得到令人困惑的结果。在对这些“异常”现象进行追踪调查后,研究人员发现,一旦涉及免疫治疗,评估肿瘤疗法是否有效的常规手段,都有可能产生误导作用。
疗效的评价
对于标准的抗癌疗法,肿瘤学家往往很快就能判断某种疗法对患者是否有效。我们可以使用各种成像手段,如CT、PET(positron-emission tomography,即正电子发射断层扫描技术)或MRI(magnetic resonance imaging,磁共振成像),来比较刚开始治疗时和治疗6周后肿瘤的大小变化。如果恶性肿瘤明显缩小,我们就可以选择继续治疗(因为我们知道这是有效的);如若不然,我们便可以考虑采用其他疗法,或者干脆停止治疗。但对于免疫疗法,事情就不那么简单了。首先,我们需要足够的时间等待免疫系统激活,所以一般要等到治疗12周以后,我们才会去测量肿瘤大小的变化。而就算再加上6周的观察与治疗时间,CTLA-4阻断试验的结果依然不甚明朗。扫描结果显示,一些患者的肿瘤明显缩小了,而另一些患者的肿瘤却增大了——甚至还出现了新的肿瘤。然而,那些体内肿瘤增大了的患者,身体的感觉往往更好。
经过免疫治疗后,患者体内的肿瘤为何会增大?现在我们有两种可能的解释:一是治疗没有效果;还有一种可能是,大量的T细胞和其他免疫细胞进入恶化组织,导致肿瘤变大了。换句话说,肿瘤的增大,恰恰代表治疗起了作用,只需再假以时日,肿瘤就会缩小。免疫疗法的疗效很难通过测量肿瘤体积来判断,因此,研究人员采用了一个既简单又重要的标准来评判伊匹单抗的疗效,将其作为最有说服力的分析结点,这一标准,就是“整体存活期”(overall survival,即患者的生存时间)。
最新的临床试验结果显示,在接受伊匹单抗治疗后,20%以上的转移性黑色素瘤患者的病情在较长时间内得到了控制,治疗后的存活时间达到了3年以上。这一结果已相当令人瞩目,因为在伊匹单抗这样的现代药物出现之前,转移性黑色素瘤患者的中位预期寿命(median life expectancy)仅为7~8个月。事实上,一些较早参与试验的受试者——比如雪莉,在经过治疗后,已经生存了5年以上。
与此同时,我们对免疫疗法的研究,已经推进到了第二个关键的分子刹车——PD-1上。这是一种存在于许多T细胞表面的分子。当PD-1与某些特定分子结合后,能迫使免疫细胞“自杀”(和与其密切相关的CTLA-4蛋白一样,PD-1也是一种行使正常生理功能的蛋白),从而终止正在进行的免疫反应。然而,一些肿瘤细胞进化出了一种防御机制,它们的表面带有能与PD-1蛋白结合的分子,从而诱导T细胞过早地进入自我破坏程序。如此一来,T细胞在攻击肿瘤细胞时,反而会接收到“自杀”的信号。肿瘤细胞已经练就了许多逃避免疫系统方法,而这只是其中之一。
默克公司、医学免疫公司和基因泰克公司(Genentech)都各自研发了相关抗体,抑制肿瘤对PD-1的欺骗性诱导作用,从而“解救”与之对抗的T细胞。最近的临床试验结果显示,这些药物在30%以上的黑色素瘤患者中,都起到了长期性的缓解作用,在有些患者中,这种缓解作用甚至能持续好几年。并且,在这30%的患者中,还有一些是对伊匹单抗的治疗没有反应的。我在纪念斯隆-凯特琳癌症中心的几位同事,已经和其他机构的合作者一道,试验了PD-1阻断剂对一类肺癌患者的疗效:20%以上的受试者,体内的肿瘤都得到了持续性的抑制。
我们在2013年11月报道了上述肺癌治疗的临床试验结果。事实证明,这成为了免疫疗法的转折点。那些曾对免疫疗法心存疑虑的医生们,再也不能将其当做一种“小众”的疗法——之前的那些试验,只能证明免疫疗法对几种特定的肿瘤有效(例如黑色素瘤和肾癌)。而今,免疫疗法在肿瘤治疗领域有了更广阔的前景。未来,免疫疗法很有可能和化疗、放疗一样,成为许多肿瘤的常规治疗手段。
与绝大多数的肿瘤疗法一样,免疫疗法也会引起一些副反应。以使用抗CTLA-4药物的患者为例,很多患者会因免疫细胞释放的大量刺激性化学物质,产生皮肤和小肠的炎症反应,从而表现出红疹、肠绞痛和腹泻的症状。患者往往需要服用抑制免疫反应的类固醇药物(如强的松)来控制这些副作用。使用PD-1阻断药物的患者,也可能发生这类副反应——尤其是肾癌、肺癌和肝癌患者,但是,这些副反应的发生频率和严重性,都要比使用CTLA-4阻断剂时来得要低。幸运的是,使用抗炎药物,并不会影响这些抗肿瘤药物的疗效。
炎症反应也可能引起更严重的问题。长期以来,研究人员们一直担心,免疫疗法使用的药物会使免疫反应越演越烈,以至于激发全面的自身免疫反应——在这种情况下,免疫系统会攻击很多正常组织,而机体却无法阻止。还好,与真正的自身免疫疾病不同,这些副作用似乎是暂时性的,一旦经过治疗,就不会复发。
抗PD-1和CTLA-4的抗体似乎可以通过不同的途径,增强免疫系统对抗肿瘤的能力,因此,我们非常有必要研究一下,将两种药物一同使用,是否同样安全、有效。2007年的一项研究显示,在患有结肠癌和黑色素瘤的实验动物身上联用CTLA-4和PD-1阻断剂,比单独使用其中任何一种都更有效。因此,在2010年与耶鲁大学的马里奥·斯诺尔(Mario Sznol)合作进行的研究中,我们决定进行一项小范围的药物安全试验,在53位患有转移性黑色素瘤的受试者中,联合使用伊匹单抗和抗PD-1的抗体nivolumab。
我们在去年的一个医学会议上报告了该项试验令人惊叹的研究结果。在接受了最优剂量的药物的治疗后,超过50%的受试者体内的肿瘤缩小了一半以上。与单独使用以上任一种抗体的患者相比,联用两种抗体收到了更明显的效果。诚然,患者身上表现出了更多的副反应,但都可以通过类固醇药物进行控制。我必须指出的是,这还只是小范围试验的初步结果,我们并不确定,当患者范围扩大、治疗时间延长,联用两种药物又会表现出什么样的疗效。目前,我们正在进行一项更大范围的联用药物试验,招募了900多位黑色素瘤患者。
另外,还有一些研究人员,正在将这种“联合免疫疗法”应用到更多种肿瘤的治疗当中,其中包括肺癌、肾癌、胃癌、乳腺癌、头颈癌和胰腺癌。研究表明,其他一些直接攻击肿瘤细胞的疗法——比如化疗或放疗——在杀伤肿瘤时,可以触发机体的固有免疫系统,而这能够强化免疫疗法的作用。对于肿瘤来说,这是一场完美的“末日风暴”,因为放化疗产生的肿瘤碎片,能更有效地被免疫系统识别和攻击。这种组合式的治疗,也使T细胞形成了对肿瘤细胞的记忆。加强了警惕性的T细胞,足以在治疗停止后的很长一段时间内,防止肿瘤的复发。此类联合性免疫疗法,还可进一步与其他正在研发中的免疫治疗手段联合使用——比如肿瘤疫苗,这种联合是否会带来更好的疗效,我们拭目以待。
现在,我们已经能将标准的抗肿瘤疗法与增强自身防御功能的免疫疗法联合起来,因此我相信,长期抑制、甚至治愈肿瘤的梦想,已开始变为现实。
撰文/杰德· D ·沃夏克(Jedd.D.Wolchok),翻译/戴晓橙(复旦大学预防医学硕士,曾任职于复旦大学医学中心)
》》》》2018年8月,基于相关成果研制的肿瘤免疫治疗代表性药物PD-1抑制剂K药、O药刚刚进入中国,被称为广大癌症晚期患者的“神药”。那么,免疫药物如何救命?哪些患者可以使用免疫疗法?请看FDA专家的深度解析——
“广谱抗癌神药”登陆中国 ,哪些患者才是幸运儿?
—肿瘤免疫治疗深度解析
撰文/胡志远(美国FDA体外诊断免疫器械评审专家、中国科学院国家纳米科学中心教授)
编辑/吉菁菁 新媒体编辑/陈炫之
2015年8月20日,近91岁高龄的美国前总统吉米·卡特宣布自己确诊罹患晚期黑色素瘤,转移到脑中的4个瘤块约2毫米大小,准备向世界告别。幸运的是此时神药横空出世,他在PD-1药物的治疗下,3个月之后肿瘤奇迹般的消失了。直到今天,并无任何复发迹象。
上市仅仅几个月, 美国默沙东的Keytruda就荣获2015美国盖伦奖(Prix Galien Award) 最佳生物技术产品奖(Best Biotechnology Product)。该奖项被誉为医学界的“诺贝尔奖”, 用以表彰对人类健康带来深远影响的杰出新药发现, 是药物研发领域的最高殊荣。
从此,针对肺癌、淋巴瘤、肝癌、胃癌、结直肠癌等十多个恶性肿瘤的一系列临床试验大获成功。一个全新时代开启了,治愈肿瘤不再是梦。
三年后的2018年8月28号,以默沙东的Keytruda(简称K药,也叫帕博利珠单抗)和施贵宝Opdivo(简称O药,也叫纳武单抗)为代表的“PD-1/PD-L1免疫治疗药物”正式进入中国,令国内广大肿瘤患者和家人欢欣鼓舞,这代表以前很多无药可治的晚期病人终于有了救命的“广谱神药”。
免疫治疗药物如何“救命”
——使肿瘤细胞“良民证”失效
肿瘤免疫治疗(Immuno-Oncology,IO)是通过调动机体的免疫系统,增强抗肿瘤免疫力,从而抑制和杀伤肿瘤细胞。肿瘤免疫治疗的代表性“PD-1/PD-L1药物”是当前肿瘤治疗领域中最具前景的方向之一。
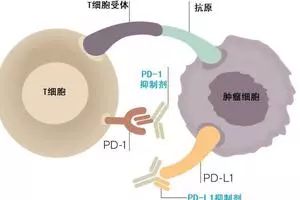
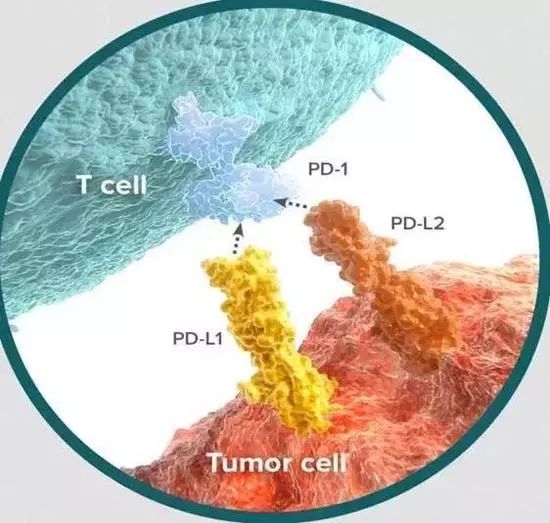
PD-1抑制剂,包括PD-1抗体和PD-L1抗体,是一类免疫治疗的新药。主要的作用机制,是阻断PD-1和PD-L1之间的相互作用,因为这两个蛋白的相互作用,会帮助恶性肿瘤逃脱免疫系统的追杀,典型的“金蝉脱壳”。PD-1/PD-L1抗体,通过阻断这种“欺骗的伪装”,促进病人自身的免疫系统杀伤肿瘤。
简单来说,肿瘤细胞为了逃避人体免疫的追杀,在自身表面产生了一种被称为“PD-L1”的蛋白,相当于一个假的“良民证”。这个蛋白与免疫细胞表面的PD-1蛋白相结合,就会让人体免疫系统产生“这是良民”的错觉,从而放过肿瘤细胞,任其疯狂繁殖。
通过使用PD-1PD-L1抑制剂,使得肿瘤细胞的“良民证”失效(如上图)。这样肿瘤细胞就会被免疫细胞果断识破,对其持续围剿,从而达到病情缓解甚至治愈。
PD-1/PD-L1是“万灵神药”吗?
——筛选病人是最大难题
肿瘤免疫治疗已成为继手术、化疗、放疗、靶向治疗后肿瘤治疗领域的又一重要手段。但PD-1/PD-L1抑制剂在临床实践中却面临很多的问题,比如治疗周期长,进口药物费用高昂(美国的治疗费用大约15万美金/年,相当于人民币接近100万)。中国目前看一年的费用也在50万人民币上下。贵也就算了,关键是——还不是对每个患者都有效!
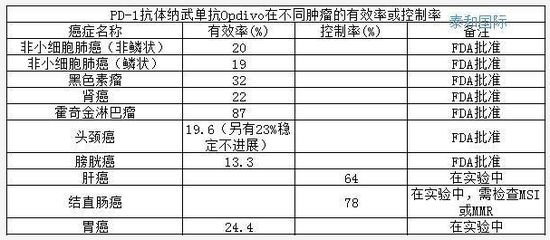
针对大部分实体瘤,PD-1抗体的有效率大概10%-50%。用在不合适的人身上,不但不能缓解病情,还可能延误病情,造成疾病进展。因此,全世界科学家、医生和患者最关心的问题是:“神药”在手,到底如何筛选合适的病人。
如何判断谁是“幸运儿”?
——生物标志物是最快速直接的手段
生物标志物(biomarker)作为最直接快速有效的检测手段,为了让患者能受到准确有效的治疗,生物标志物就担起了筛选患者、分类患者的重担,准确找出有药物响应的患者,让他们尽早接受最好的治疗。
目前研究较为深入的与PD-1抗体疗效相关性较大的生物标志物主要是1。 PD-L1阳性表达情况(PD-L1伴随诊断),2。肿瘤突变负荷(TMB),3.MSI和4。 EBV。
近期,由韩国科学家组成的研究团队,在著名期刊Nature Medicine发表了一篇可以写进教科书的胃癌免疫治疗研究成果[1]。
他们在每个患者身上把这几个生物标志物:PD-L1、MSI、TMB、EBV都仔仔细细全测了一遍。结果发表在影响因子32.621的重量级期刊Nature Medicine上。不同的生物标志物给出了非常不同但又非常有意义的结果。
筛选“幸运儿”的标志物有哪些?
——这些标志物都很优秀
1。 PD-L1
PD-L1是一种在肿瘤细胞表面表达的蛋白,而免疫T细胞的表面表达PD-1蛋白。
神奇的免疫治疗其实就是通过单克隆抗体保护PD-1,因此,PD-L1蛋白高表达的肿瘤细胞无疑就是免疫治疗的靶子。现在这是最热的免疫治疗标志物。
相关临床研究表明,PD-L1的表达与PD-L1/PD-1抑制剂的疗效相关,随着PD-L1表达升高疗效增加,疾病控制时间延长,而且预后改善。现已开展的很多关于PD-L1检测的临床试验表明,PD-L1表达阳性对预测免疫治疗在非小细胞肺癌、黑色素瘤、胃癌、食管鳞状细胞癌等多瘤种的疗效上都起到重要作用。
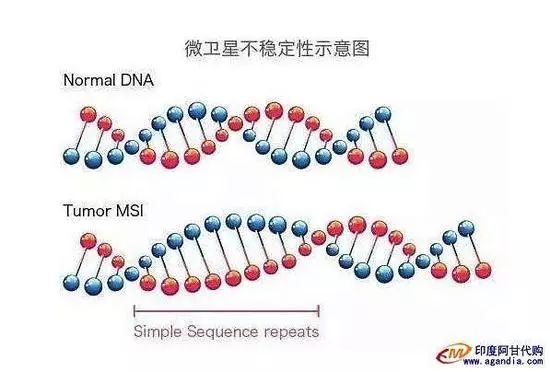
2。 MSI
微卫星不稳定性(Microsatellite instability,MSI)也是明星生物标志物之一,微卫星序列(Microsatellite,MS)在真核生物基因组中约占5%,是基因重组和变异的来源。
MSI便是由于在遗传物质复制过程中,各种错误的累积所致。肿瘤细胞的DNA突变多表现在微卫星序列异常,免疫细胞一眼就看出来有问题。
MSI最大的问题是应用很少,只有在很少的癌种很苛刻的条件下才能使用,而且对于样本要求很高,很多时候需要手术或者穿刺。
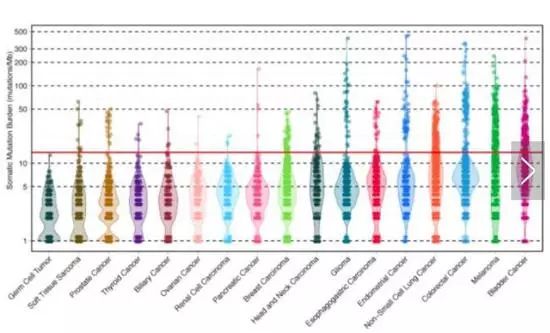
3。 TMB
肿瘤突变负荷(Tumor mutation burden,TMB)是肿瘤组织每兆碱基中突变的数目。原理和MSI非常相似,只不过突变不在MS上,而在全基因组之中。
因此,TMB高也是预测使用PD-1抗体是否有效的一个重要生物标志物。
只是TMB检测更昂贵,而且检验标准非常不统一。而且不同癌种的TMB水平也很不一样。另外年龄也是一个很大的影响因素,年龄越高TMB越高,会影响正常值。
4。 EBV
最后,让我们来看看文献中新推荐的EBV标志物,EBV就是EB病毒(Epstein-Barr virus,EBV)。
EBV是鼻咽癌和胃癌中经常出现的外来入侵者。病毒的DNA会插入到人细胞DNA基因组序列中,导致细胞增殖异常。
“明星标志物”的评价指标都有哪些?
既要“挑得出”也要“挑得准”
“明星标志物”可不是这么好当上的,得经过重重指标的考验,仅凭ORR(Overall Response Rate总体反应率)还不能判断,还得靠敏感性、特异性统计学指标来统一评价。
敏感性、特异性,主要反映诊断标志物预测的能力,是一个标志物准或者不准最直接的评价标准,主要用于从已经确定是癌症患者的群体中,挑出可能有药物响应的那部分。
敏感性是“挑得出”,特异性是“挑得准”。
根据文献中提供的PD/SD/PR/CR的四种患者用药效果,我们计算每一个生物标志物的敏感性和特异性,得出:
PD-L1的敏感性=100%,特异性=63.16%
EBV的敏感性=40%,特异性=100%
MSI的敏感性=40%,特异性=97.62%
TMB的敏感性=42.86%,特异性=94.87%
PD-L1的敏感性是满分-“挑得出”,意味着每一个用药有效的患者都被PD-L1这个标记物挑出来了。而其它标记物的敏感性都在40%上下,意味着有60%的有效患者被预测为无效,让大部分用药有效患者失去用药的宝贵机会。
当然另外三个生物标志物也有优点,特异性高意味着“挑得准”,挑出来阳性的患者都是对药物有反应的,没有误挑出来的。但是和漏诊使患者失去了用药的机会相比,宁愿多挑出一些也不能漏过。
PD-L1的敏感性100%,患者不会漏诊,大大提高了药物的有效性,是优秀的生物标志物。
☆☆☆
PD-L1药物如何脱颖而出?
——“瑜亮之争”奠定江湖地位
当默沙东公司开始启动肺癌临床项目时,他们觉得自己落后BMS(百事美施贵宝)好几年,他们获得快速批准的机会只能是在一线治疗中展示出非常好的响应率。如何实现这一目标是一大挑战,他们决定求助于新的生物标志物——PD-L1的阳性表达。施贵宝则更看重另一个标记物TMB,与TMB不同,PD-L1是PD1的天然配体,是药物的作用位点。
默沙东团队希望通过选择具有高水平PD-L1的肿瘤患者达到提高疗效的目标。这次他们的策略成功了,科学战胜了商业利益。
在一项名为Keynote-024的开放III期临床试验中,PD-L1表达>50%的非小细胞肺癌患者中,和化疗相比, Keytruda(Merck公司的抗PD-1药物)降低了50%的疾病进展风险和40%的死亡风险。Keytruda相比化疗,PFS(无进展生存期,12.5对6个月)和OS(总生存期,30对14.2个月)都有显著提高!
而施贵宝的临床试验由于选择了错误的标记物宣告失败。这场BMS和Merck之间的瑜亮之战奠定了PD-L1蛋白标记物伴随诊断的王牌江湖地位。默沙东之后的多个癌种的临床试验都在依据PD-L1的阳性表达而展开,据最近的一项美国主流医生的调查结果,在非小细胞肺癌的一线治疗前,73%的医生非常愿意(very likely)选择PD-L1检测,27%的医生很愿意(likely)选择PD-L1检测,不选择检测的医生比例是零。
而如今PD-1作为一个可以对应于多种癌种,并有显著治疗效果的药物,已经得到了美国FDA的审核,PD-L1非小细胞伴随诊断被收入美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)临床实践指南之中,NCCN是临床医生人人必读的指南,临床诊断和治疗常以指南内容为金标准。
☆☆☆
PD-L1缺点如何克服?
肿瘤捕手可精准挑出获益人群
目前病理上PD-L1检测虽然有效,但还不是完美的。有以下几个缺点:
不够标准化:病理的判读还是过于依赖病理医生的个人经验。
假阴性:越来越多的数据证明IHC的结果有比较多的假阴性,尤其在活检穿刺的样品。由于PD-L1表达在组织上的空间异质性,穿刺样品由于组织量的局限,经常导致假阴性。
无法取得组织。大约有40%的患者因为不愿意,或者实际操作的原因,都获得不到组织样本。
即使有了组织样本,由于时效性以及取样痛苦性,不能经常获得动态、实时的数据。
针对这一问题的解决方案就在于液体活检。利用灵敏的液体活检CTC检测技术,可以检测出游离于外周血中的肿瘤细胞,再进行分析,就精准可以测出CTC上的PD-L1表达。比如中科院的肿瘤捕手CTC PD-L1伴随诊断技术,应用准确定量的纳米医学免疫荧光技术,可以做到更精准的PD-L1表达分析,从而挑出获益人群。[2]
这个技术只需抽血,就可以指导患者是否需要采用“抗癌神药”,可重复检测,具有高灵敏度、高特异性、操作简便、动态实时的优点,把PD-L1伴随诊断技术推向了新的高度。
在2018年ASCO会议上,肿瘤捕手团队发布了和恒瑞、信达等中国药企合作的PD-1药物在消化道肿瘤临床试验结果,显示CTC PD-L1伴随诊断检测与药物具有高相应,可以将平均不到20%的反应率提升到64%。
科学就是这样,不断进步,不断前行。目前国际上,利用CTC PD-L1伴随诊断(Companion Diagnostics)细分患者群体,确定最佳治疗策略,有助于将PD-1/PD-L1药物推向一线,推向更早期,这就是肿瘤患者真正春天的到来。
来源:北京科技报 时间:2018-10-03
推荐阅读:福建都市